Mitől nehéz a nehézvíz?

(Paksi atomerőmű)
Hallottál már a nehézvízről? Fontos szerepe volt az első atombombák előállításában. Atomreaktorokban ma is használják (1. ábra). De mitől nehéz a nehézvíz? Attól, hogy benne a hidrogénatom „nehéz” változata, a deutérium található. Ahhoz, hogy ezt megértsük, tekintsük át az atomok felépítését és szerkezetét!
Az atom atommagból és az azt körülvevő elektronburokból álló semleges kémiai részecske. Az atommagban találhatók a protonok és a neutronok (1. táblázat). Az atommagot felépítő elemi részecskéket összefoglaló néven nukleonoknak („magot alkotónak”) is nevezzük.
| Elemi részecske | Jele | Tömege (m) |
Relatív tömege (mr) |
Töltése (Q) |
Relatív töltése (Qr) |
| Proton | p+ | 1 | +1 | ||
| Neutron | n0 | 1 | 0 | 0 | |
| Elektron | e– | 1/1836 | –1 |
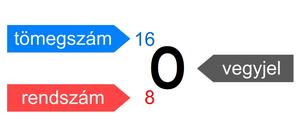
Az atom jelölésére vegyjelet használunk (2. ábra). A vegyjel mellett gyakran feltüntetjük az atom két jellemző adatát: a rendszámot és a tömegszámot. Az atom minőségét az atommagban lévő protonok száma határozza meg. Az atommagban található protonok számát adja meg a rendszám (Z). Mivel az atom tömegét lényegében csak az atommagot alkotó protonok és neutronok tömege határozza meg, ezért a protonok és neutronok számának összegét tömegszámnak (A) nevezzük. A tömegszám számértéke közel azonos a relatív atomtömeg számértékével. A relatív atomtömeg a vizsgált atom tömegének és az atomi tömegegységnek a hányadosa.
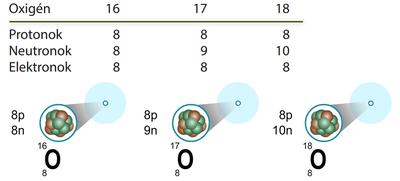
Számos olyan atom van, amelyeknek azonos a rendszáma, de különböző a tömegszáma, tehát atommagjukban azonos számú proton, de eltérő számú neutron található. Az ilyen atomokat nevezzük izotópatomoknak (3. ábra). A különböző tömegű izotópatomokból különböző tömegű molekulák képződhetnek. A két „nehéz” hidrogénatomot (deutériumot) és egy oxigénatomot tartalmazó vízmolekula tömege nagyobb, mint a természetben legnagyobb mennyiségben előforduló vízmolekuláé. Ezért nevezik nehézvíznek a
| Jel | Név | Előfordulás |
| hidrogén, prócium | 99,985% | |
| deutérium, nehézhidrogén | 0,0115% | |
| trícium | <0,003% |
Gondoltad volna?
Tömegszám mint márkanév
Elgondolkoztál már azon, hogy mit jelenthet egy üdítőital márkanevében a 7? Ez bizony a lítiumatom tömegszáma (
Gondoltad volna?
Egy modell az anyagok fénykibocsátásának értelmezésére
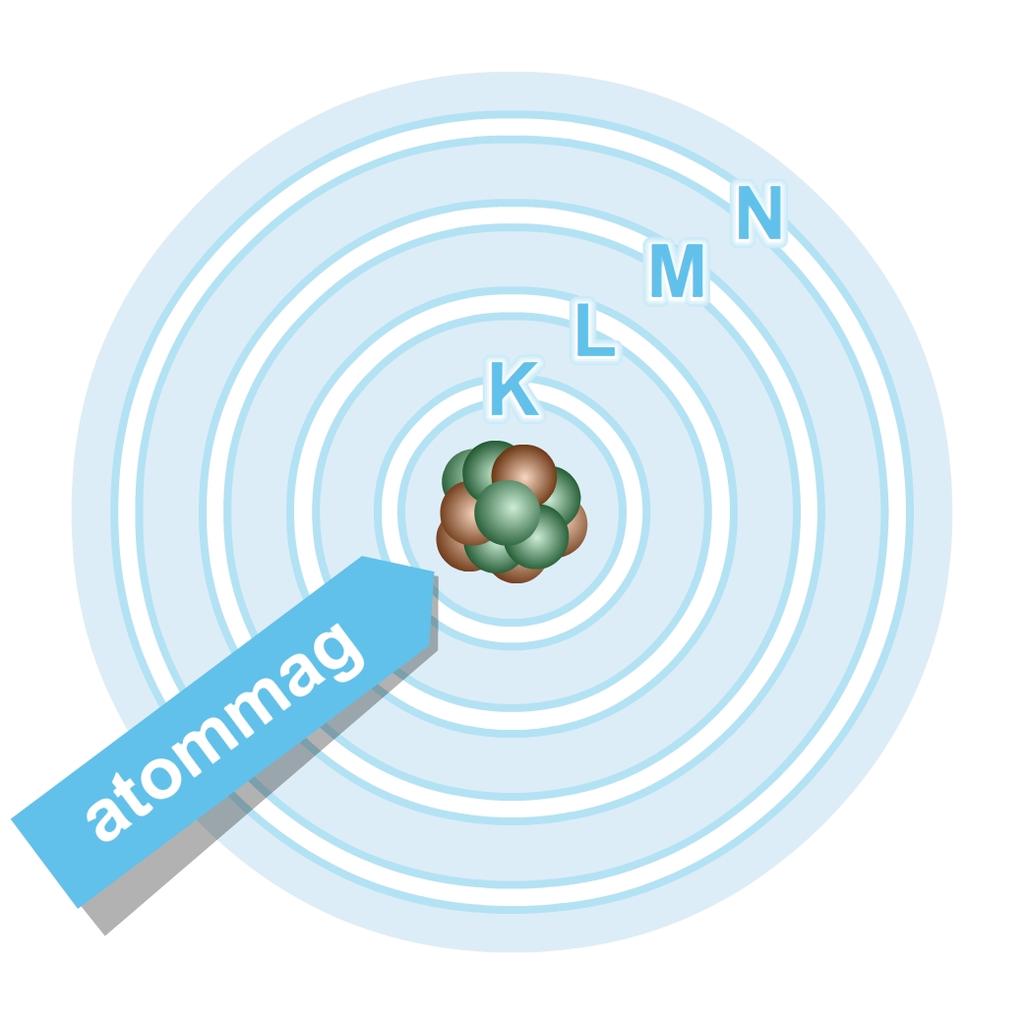
Niels Bohr (1885–1962) dán fizikus az anyagok fénykibocsátásának magyarázatához feltételezte, hogy az atomban az elektron csak az atommagtól meghatározott távolságra lévő, meghatározott sugarú kör alakú pályákon (ún. elektronhéjakon) keringhet. Minden egyes héjnak jellemző energiája van. Az atommagtól távolodva az elektron egyre nagyobb energiájú héjon kering. Ha az elektron egy magtól közelebbi héjról átkerül egy magtól távolabbi héjra, akkor ezt csak úgy teheti meg, ha energiát vesz fel a környezetéből. Ez az energia pontosan annyi, mint a két héj energiájának különbsége. Ha egy nagyobb energiájú héjról kerül vissza az elektron egy maghoz közelebbi héjra, akkor a két héj közötti energiakülönbséget az atom a környezetének adja át, például megfelelő színű fényt sugároz ki.
A Bohr-féle atommodell 1913-as megalkotása óta rengeteg olyan jelenséget tapasztaltak a fizikusok és a kémikusok, amelyet nem lehetett ezzel a modellel sem értelmezni. Ezért az elmúlt száz évben számos további, egyre bonyolultabb atommodellt alkottak és alkotnak még ma is. Mivel a kémiai átalakulások az atomok elektronszerkezetében okoznak változást, ezért mi a továbbiakban a Bohr-féle atommodellt (4. ábra) fogjuk használni a kémiai változások értelmezésére.
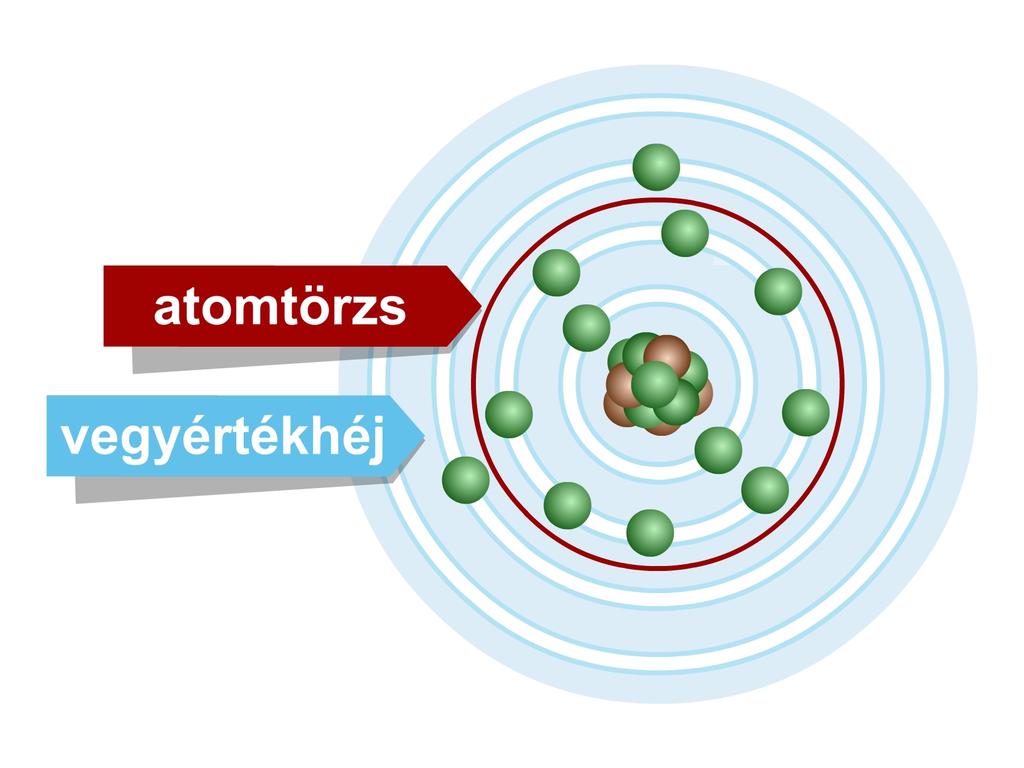
A kémiai reakció nem érinti az atommagot és a telített héjakat. Telítettnek nevezünk egy elektronhéjat, ha azon maximális számú (
A hélium és a neon esetében a külső, telített elektronhéjat nevezzük vegyértékhéjnak.
Van fogalmad?
Atom: atommagból és az azt körülvevő elektronburokból álló semleges kémiai részecske.
Rendszám: az atom magjában található protonok száma.
Tömegszám: az atom magjában található protonok és neutronok számának összege.
Izotópatomok: azonos rendszámú, különböző tömegszámú atomok.
Nehézvíz: olyan víz, amelynek molekuláiban nehézhidrogén-atom (deutérium) található.
Atomtörzs: az atommag és a körülötte lévő telített héjak.
Vegyértékelektronok: az atomtörzsön kívül található vegyértékhéjon lévő elektronok.
Elemi részecskék
- protonok, neutronok és elektronok
- jellemzőik: relatív tömeg és relatív töltés
Az atom
- elektromosan semleges kémiai részecske
- felépítése:
- atommag + elektronburok, vagy
- atomtörzs + vegyértékelektronok
- vegyjellel jelöljük
- jellemző adatai: rendszám, tömegszám és relatív atomtömeg
Izotópatomok
- azonos protonszám, különböző neutronszám