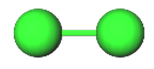Miért fontos a kézmosás?

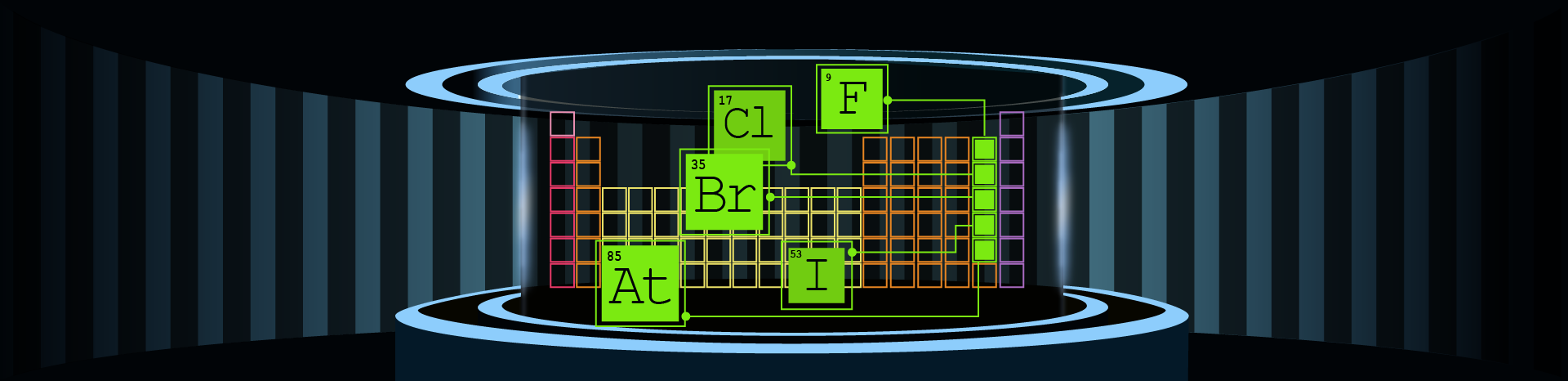
A periódusos rendszer 17. csoportját (VII.A csoportját) alkotó elemeket halogénelemeknek nevezzük. A szó jelentése „sóképző”, utalva igen gyakori előfordulási formájukra. A csoport elemei közé tartozik a fluor (F), a klór (Cl), a bróm (Br), a jód (I) és az asztácium (At).
Számos olyan elem van, amely tiszta, elemi állapotban akár veszélyes is lehet az élő szervezetre, ugyanakkor átalakulásukat követően létfontosságú vegyület jön létre. Például az emberi szervezetre igen veszélyes nátriumot és a mérgező klórgázt reagáltatva az élő szervezet számára kiemelt jelentőségű nátrium-klorid, vagyis konyhasó keletkezik.
A klóratom hét vegyértékelektronnal rendelkezik. Két klóratom egy-egy párosítatlan elektronját közössé téve kétatomos elemmolekula jön létre (2. ábra).
A klór sárgászöld színű, szúrós szagú, köhögésre ingerlő gáz. Az apoláris molekulákat gyenge másodrendű kölcsönhatás tartja egyben, ezért azokat nagyon könnyű eltávolítani egymástól, így alacsony olvadás- és forráspont jellemzi.
Az apoláris klórgáz az apoláris oldószerekben (például benzinben) jól, poláris oldószerekben viszont rosszul oldódik. A vízben való kismértékű oldódását reakció is segíti.
A levegőnél sokkal nagyobb sűrűségű gáz, ezért lefelé száll. Ha klórgázt szeretnénk felfogni, azt szájával felfelé tartott edényben tehetjük meg.
Gondoltad volna?
A halogénelemek
A fontosabb halogénelemek neve a görög vagy latin nevükből származtatható:
fluor (F): fluere = folyni (latin)
klór (Cl): chloros = zöld (görög)
bróm (Br): bromos = bűzlő (görög)
jód (I): iodeies = ibolyaszín (görög)
Tudod? Jó, ha tudod!
Az anyák megmentője

Az „anyák megmentőjeként” megismert Semmelweis Ignác Fülöp (3. ábra) gyermekek és anyák százainak életét mentette meg annak felismerésével, hogy a sok élet kioltásáért felelős gyermekágyi láz a megfelelő hatékonyságú kézmosás hiánya miatt terjed. Ő adott utasítást az orvosoknak a klórmeszes kézmosásra minden szülőszobára való belépés előtt!
Gondoltad volna?
Fertőtlenítés nem csak klórral
A klórgáz nátrium-hidroxid-oldatban való elnyeletésekor nátrium-hipoklorit (
A klór éghetetlen gáz, az oxigénnel nem lép reakcióba. Fény hatására hidrogénnel robbanásszerű reakcióba lép.
A klórgáz nagy reakcióképessége miatt elemi állapotban csak nagyon kevés helyen fordul elő a természetben. Egyes vulkáni gázok összetevőjeként jelenik meg.
Felhasználása igen széles körű. Baktériumölő, fertőtlenítő hatása miatt a vezetékes vizek kezelésekor alkalmazzák. A festékeket roncsolja, így a textilipar is használja.
A klórgáz nagyon mérgező, a nyálkahártyát ingerlő gáz, belélegezve tüdővizenyőt okoz.
Gondoltad volna?
A só érték

Az ókori Rómában a katonákat gyakran nátrium-kloriddal, vagyis sóval fizették ki, annyira értékes anyagnak számított. Az angol salary (fizetés) szó is a só latin nevéből a „sal”-ból ered. Másik neve is ezt az értéket tükrözi: a „föld fehér aranya”.
Gondoltad volna?
A fluor, a bróm és a jód
A fluor egy zöldessárga színű, szúrós szagú gáz. Igen erélyes oxidálószer.
A bróm az egyetlen cseppfolyós nemfémes elem. Vörösbarna színű, szúrós szagú, vízben kismértékben oldódó, mérgező elem. A szerves vegyületek többszörös kötéseinek kimutatására használják.
A jód fémesszürke színű, szilárd halmazállapotú anyag. A gőze lila színű. Alkoholban barna színnel, benzinben lila színnel oldódik. A keményítővel kék színreakciót mutat. Alkoholos oldatát (jódtinktúra) fertőtlenítésre használják (6. ábra).
Van fogalmad?
Halogén: sóképző anyag.
A klór
- kétatomos klórmolekula
- sárgászöld színű, szúrós szagú, köhögésre ingerlő, levegőnél nehezebb, mérgező gáz
- leginkább vegyületeiben fordul elő a természetben
- fertőtlenítő, festékroncsoló hatású
- fontos vegyülete: a nátrium-klorid